BLOG QUE TIENE LA FINALIDAD DE COMPARTIR TRABAJOS CON MIS ALUMNOS Y PADRES DE FAMILIA Y COMO MEDIDA DE COMUNICACIÓN.
miércoles, 18 de mayo de 2016
TÉCNICA, SOCIEDAD DEL RIESGO Y PRINCIPIO PRECAUTORIO
1.- ¿Qué es Técnica?
La técnica es un conjunto de saberes prácticos o procedimientos para obtener el resultado deseado y proviene del griego téchne, que significa arte. Una técnica puede ser aplicada en cualquier ámbito humano: ciencias, arte, educación etc. Aunque no es privativa del hombre, sus técnicas suelen ser más complejas que la de los animales, que sólo responden a su necesidad de supervivencia. En los humanos la técnica muchas veces no es consciente o reflexiva, incluso parecería que muchas técnicas son espontáneas e incluso innatas.
La ténica requiere de destreza manual y/o intelectual, generalmente con el uso de herramientas. La técnica surgió de la necesidad humana de modificar su medio. Nace en la imaginación y luego se lleva a la concreción, siempre de forma empírica.
2.-¿Qué es el la Sociedad del riesgo?
Esta es la obra más importante del sociólogo alemán Ulrich Beck, escrita en la década de 1980 bajo los efectos de la catástrofe nuclear de Chernobyl. Aquí plantea que vivimos el pasaje desde la modernidad industrial hacia una sociedad del riesgo, a través de una transformación producida por la confrontación de la modernidad con las consecuencias no deseadas de sus propias acciones. El desarrollo industrial no regulado por el sistema político produce riesgos de una nueva magnitud: son incalculables, imprevisibles e incontrolables por la sociedad actual. Además, estos riesgos no pueden afrontarse desde los Estados Nación por cuanto trascienden sus fronteras. Ello implica que surge objetivamente una comunidad mundial, que falta -y será necesario- construir de forma política.
La sociedad del riesgo implica una serie de cambios que pintan un paisaje de la actualidad e invitan a reflexionar:
a) el pasaje de una sociedad de clases a una sociedad de riesgos (según Beck, el smog es democrático puesto que su efecto alcanza a todas las clases sociales).
b) el pasaje de una sociedad estamental, de identidades fijas sostenidas en la etnia, la religión, el trabajo, a una sociedad de individuación cada vez mayor, en la que las personas construyen sus trayectorias en forma reflexiva, escogiendo sus trabajos, sus parejas, sus modos de vivir.
c) el cambio del estatuto de la ciencia, desde una situación de monopolio del saber, hacia un escenario en el que las opiniones de expertos compiten con el saber lego y con la racionalidad social.
3.- ¿Qué es el Principio precautorio?
El Principio Precautorio resulta en la actualidad un concepto esencial en el derecho ambiental y en toda política social que tiene como fin mediato a la persona humana y el entorno donde se desarrolla.
El Principio precautorio nace como parte de la cultura social, de los usos y costumbres de los pobladores que no sólo buscan proteger el medio ambiente que lo rodea, sino el mantener la convivencia entre ese medio y el desarrollo de la vida humana presente y futura. Es así que no puede concebirse la idea de desarrollo de la vida humana en un entorno aislado, depredado o consumido por la actividad industrial o tecnológica, aunque si bien éstos forman parte del progreso de los pueblos; sin embargo la concomitancia entre un ambiente equilibrado y la salud de los miembros de la comunidad tienen el estandarte prioritario de la gestión social de todos sus integrantes.
El concepto sociedad del riesgo, ampliamente definido por Ulrich Beck, se basa en la constatación de que, en las sociedades actuales, la producción social de riqueza va acompañada sistemáticamente por una creciente producción social del riesgo. En las sociedades contemporáneas, una proporción bastante elevada de estos «riesgos» está directamente relacionada con la tecnología y el sistema productivo, y se caracteriza porque trata de riesgos difícilmente detectables por los sentidos humanos.
La contaminación química, la modificación genética de organismos o los efectos del cambio climático son algunos ejemplos de nuevos riesgos ambientales que se vienen a sumar a las terribles consecuencias provocadas por la contaminación industrial en las últimas décadas del siglo XX.
Chernobyl (Ucrania), Accidente nuclear Población afectada 5.500.000 personas. “El sarcófago nuclear” (Julien Behal). Imagen extraída del Blacksmith Institute
Sin embargo, el análisis no sería completo si no añadiéramos a la lista de riesgos, el peligro latente de ruptura social que la globalización y los nuevos procesos de transformación económica están provocando en el seno de nuestra sociedad. La progresión y el aumento de estos nuevos riesgos está teniendo consecuencias políticas claras.
Un primer efecto directo consistiría en la implementación, por parte de los gobiernos, de políticas orientadas al control y a la reducción de los riesgos. Sin embargo, no cabe descartar un segundo efecto, de mayor calado que el primero, que está directamente relacionado con el fracaso de dichas políticas de control y con la opacidad informativa que, generalmente, practican los gobiernos y que, forzosamente, conduce a la deslegitimación de las instituciones públicas. Por lo tanto, es plausible afirmar que la sociedad del riesgo se origina allí donde los sistemas normativos y las instituciones sociales fracasan a la hora de conseguir la necesaria seguridad ante los peligros desencadenados por la toma de decisiones.
Toda decisión debe guardar un escrupuloso equilibrio entre los beneficios devengados y los posibles riesgos y, por supuesto, debe incluir suficientes garantías de seguridad y de transparencia para evitar que ésta sea refutada públicamente. A modo de ejemplo, la decisión de alejar el Prestige de las costas gallegas (noviembre de 2002), fue un tremendo error, no sólo por su improvisación, sino, sobre todo, por el incumplimiento de las precauciones mínimas de seguridad y por la opacidad en la acción de gobierno, y tuvo como consecuencia el mayor desastre natural que ha sufrido la costa española a lo largo de este siglo.
Chernobyl (Ucrania), Accidente nuclear Población afectada 5.500.000 personas. “Secuelas de la radiación” (Julien Behal). Imagen extraída del Blacksmith Institute
Riesgo, peligros e incertidumbre (algunos ejemplos)
Linfen, (Corazón industrial de China) Contaminaciones del aire. Población afectada 3.000.000 personas. “Joven afectado” (Andreas Haberman) Imagen extraída del Blacksmith Institute
La percepción de la crisis ecológica: El estado del medio ambiente ocupa, desde hace años, un lugar visible en la lista de asuntos de interés para la opinión pública. Las cuestiones ambientales «han dejado de ser materia de preocupación casi exclusiva de grupos minoritarios más o menos radicales, para convertirse en problemas de importancia general» (Garcia Ferrando, 1991: 176). La preocupación por el medio ambiente se sitúa sólo después del desempleo y el orden público, y en niveles similares a las cuestiones relativas a la desigualdad social.
Valle de Sukinda (India), minería. El 60% del agua potable contiene cromo tóxico. Población afectada 2.600.000 “Aguas contaminadas” (Petros Morgos) Imagen extraída del Blacksmith Institute
La percepción de los riesgos sobre la salud: En las sociedades occidentales, existe una clara percepción de peligro sobre aquellos riesgos que afectan directamente a la salud de las personas y que, en los últimos tiempos, se ha incrementado preocupantemente como consecuencia de los desastres, los escándalos y los nuevos riesgos ambientales que amenazan a la salud pública. La enfermedad de las «vacas locas», las dioxinas o los preocupantes niveles de mercurio que contiene el pescado que consumimos, son realidades que contribuyen a que la sociedad interiorice una sensación de inseguridad ambiental y de incertidumbre cotidiana cada vez más amplia, que, paradójicamente, es una consecuencia no deseada del modelo productivo y cuyo origen se encuentra en la aplicación de tecnologías poco respetuosas con el medio natural y en la nula ética social de determinadas decisiones empresariales.
Los nuevos riesgos laborales (desregularización y precarización): Sin embargo, la sociedad del riesgo no únicamente está relacionada con los aspectos ecológicos, biotecnológicos o alimentarios, sino que también mantiene una estrecha relación con los riesgos laborales, que, históricamente, han estado muy relacionados con la salud laboral y con el grado de accidentalidad dentro del espacio de trabajo. Durante la primera industrialización (siglo XIX y primer tercio del siglo XX), existe una clara percepción social que considera que el riesgo laboral es un hecho inevitable y atribuible casi en exclusiva al trabajador, que es señalado como el principal responsable de su salud y seguridad laboral. A lo largo de este periodo, trabajo y riesgo no parecen estar relacionados y los accidentes sólo son atribuidos a la fatalidad o a la temeridad de los obreros.
La precarización como nuevo riesgo laboral: El concepto precarización aplicado al ámbito laboral es un término que suele referirse a la creciente importancia del empleo temporal en el conjunto del empleo asalariado. Y aunque su interpretación es muy amplia, puede definirse como un proceso genérico de degradación de las condiciones sociolaborales. En este sentido, la observancia de los fenómenos sociales dentro del campo laboral parece evidenciar que existe un claro paralelismo entre estabilidad laboral y buenas condiciones socioeconómicas, mientras que la temporalidad se corresponde, generalmente, con la pérdida de expectativas laborales, menor retribución, escasas posibilidades de promoción y un mayor riesgo de accidentalidad laboral. En otras palabras, la temporalidad en el trabajo lleva aparejada, generalmente, una degradación de las condiciones laborales propia de la contratación indefinida, sin que medie entre ambos diferencias notables de cualificación o experiencia en el trabajo.
Bhopal (India), Fuga de isocianato de metilo. La peor catástrofe industrial del mundo Población afectada 600.000 personas “Union Carbide, la fábrica abandonada” Imagen extraída del archivo de Greenpeace
Principales estrategias ecoproductivas: El rápido desarrollo tecnológico y científico de las últimas décadas, ha provocado un intenso proceso de crecimiento económico del capitalismo, que, paralelamente, ha propiciado la aparición de nuevas formas de concienciación y de percepción social del riesgo ante los numerosos daños que el sistema productivo está provocando a nuestro planeta. Los grandes grupos empresariales, conscientes de esta realidad, no han tardado mucho en elaborar nuevas estrategias tendentes a mejorar su imagen y a disminuir el impacto de su actividad sobre el medio natural.
sábado, 7 de mayo de 2016
PUNTO TRIPLE DE LAS SUSTANCIAS
PUNTO TRIPLE DEL AGUA
Tras ver en Espacioencia teorías que son tan conocidas como La ley de la Gravedad, y otras que no son para nada empíricas pero sí populares, como la ley de la atracción, queremos definir ahora qué es el Punto triple del agua, que consiste en un proceso en el que podemos decir que las tres fases del agua, coexisten de manera equilibrada.
Punto triple del agua
EL PUNTO TRIPLE DEL AGUA
Introducción
Desde siempre hemos estudiado que el agua tiene tres estados y que pasa de uno a otro si se le aplican las suficientes condiciones del frío o calor. Estos estados son sólido, líquido y gaseoso. El agua se encuentra en la naturaleza en estos tres estados, y pasa también de uno a otro para seguir con el ciclo del agua, un ciclo indispensable para la supervivencia del planeta y todos sus seres vivos.
Punto triple del agua
Sin embargo, (y esto igual te sorprende), el agua no siempre se presenta solamente en uno de estos tres estados. De hecho, con las condiciones de temperatura y de presión atmosférica adecuadas, podría llegar a presentarse en los tres estados al mismo tiempo. Es lo que se denomina triple punto del agua.
¿QUÉ ES EL PUNTO TRIPLE DEL AGUA?:
Si bien ya hemos dicho que el punto triple del agua es el punto en el que las tres fases del agua coexísten de forma equilibrada, cabe añadir que la temperatura puede variar dependiendo del líquido al que se le aplique, aunque en el caso que nos ocupa, el del agua, tenemos que decir que este punto se encuentra a 0,01ºC y 0,006 atmósferas; es decir, está prácticamente a 0ºC y a una presión unas 165 veces más pequeña que la atmosférica.
Hemos de recordar, para entender mejor de lo que os hablo, que 1 atmósfera es una presión equivalente a la presión de la atmósfera terrestre a nivel del mar. Así pues, con las condiciones anteriores el agua líquida, el vapor de agua y el hielo se pueden presentar de manera simultánea.
A partir de estas condiciones podemos decir que nos será posible cambiar el estado de toda la masa de agua a hielo, agua líquida o vapor arbitrariamente haciendo pequeños cambios en la presión y la temperatura.
Si colocamos el agua a altas temperaturas primero vamos a obtener agua líquida y, a continuación, agua sólida. Una vez superado la presión de los 190 pascales se obtiene una forma cristalina de hielo que es más denso que el agua líquida.
TABLA DE PUNTOS TRIPLES
agua
El agua no es el único elemento que puede manifestarse en los tres estados, la mayoría pueden hacerlo si se dan las condiciones adecuadas. Estas tienen como referencia la presión 0, que es la existente en la superficie de la Tierra al nivel del mar.
Aquí puedes ver una tabla con los puntos triples de los distintos elementos:
*Nota: (T) es la temperatura y (P) la presión
Acetileno 192,4 T – 120 P
Amoníaco 195,40 T- 6,076 P
Argón 83,81 T – 68,9 P
Grafito 3900 T – 10100 P
Dióxido de carbono 216,5 T – 5517 P
Monóxido de carbono 68,10 T – 15,37 P
Deuterio 18,63 T – 17,1 P
Etano 89,89 T – 8 × 104 P
Etileno 104 T – 0,12 P
Helio-4 2,19 5,1
Hidrógeno 13,84 7,04
Cloruro de hidrógeno 158,96 T – 13,9 P
Mercurio 234,2 T – 1,65 × 10−7 P
Metano 90,68 T – 11,7 P
Neón 24,57 T – 43,2 P
Óxido nítrico 109,50 T – 21,92 P
Nitrógeno 63,18 T – 12,6 P
Óxido nitroso 182,34 T – 87,85 P
Oxígeno 54,36 T – 0,152 P
Paladio 1825 T – 3,5 × 10−3 P
Platino 2045 T – 2,0 × 10−4 P
Dióxido de azufre 197,69 T – 1,67 P
Titanio 1941 T – 5,3 × 10−3 P
Hexafluoruro de uranio 337,17 T – 151,7 P
Agua 273,16 T – 0,61 P
Xenón 161,3 T – 81,5 P
Zinc 692,65 T – 0,065 P
Punto triple del agua
EL PRINCIPIO DEL PUNTO TRIPLE DEL AGUA EN OTROS EJEMPLOS:
A partir de este principio, que ya hemos visto por la tabla anterior, podemos aplicarlo en otros líquidos o de hecho en otros ejemplos.
Por ejemplo, la presión que marca el punto triple del agua fue utilizada durante la misión Mariner 9 a Marte ya que permitió tener un punto de referencia para definir “el nivel del mar”.
Misiones más recientes hacen uso de altimetría láser y gravimetría en lugar de la presión atmosférica para medir la elevación en Marte.
1 Introducción
La importancia del agua en la ingeniería difícilmente puede ser exagerada, ya que aparece en toda clase de aplicaciones. En el campo de la termodinámica técnica, es el componente esencial de las máquinas de vapor, entre otras aplicaciones.
A modo de introducción, en este artículo se comentan algunas de las propiedades de esta sustancia. En especial, sus aspectos termodinámicos de su fase líquida, de su fase gaseosa y del estado de equilibrio entre ambas.
2 Fases del agua
En sus estados más habituales, el agua se presenta en tres formas: una sólida (hielo), una líquida (llamada simplemente agua) y una gaseosa (vapor de agua). No son los únicos estados posibles, ya que existen diferentes formas de hielo, según como cristalice.
A una presión ambiente de 101 kPa (1 atm), el agua se encuentra en forma de hielo por debajo de la temperatura de fusión 273.15 K (0.00°C) y de agua por encima de esta temperatura hasta la temperatura de ebullición 373.13K (99.98°C). Por encima de esta temperatura se encuentra en forma de vapor de agua.
La temperatura de fusión y la de ebullición son funciones de la presión.
A una presión mayor la temperatura de ebullición se eleva. Así, a una presión de 400 kPa, la temperatura de ebullición es de 417 K (144°C). Este es el principio de las ollas a presión, que consiguen alcanzar una mayor temperatura en forma líquida.
La temperatura de fusión depende mucho menos de la presión. El agua es excepcional respecto a la mayoría de las sustancias en cuanto a que al aumentar la presión la temperatura de fusión disminuye (normalmente aumenta). Este es el principio que permite patinar sobre hielo. El hielo no es para nada resbaladizo. Sin embargo, al ejercerse una presión sobre él se forma una fina capa de agua que permite el deslizamiento.
Una mezcla de agua y hielo a la temperatura de fusión se encuentra en equilibrio térmico. Ni el hielo se derrite, ni el agua se congela. Asimismo, a la temperatura de ebullición, el agua se encuentra en equilibrio térmico con el vapor de agua.
Existe una presión a la cual la temperatura de fusión y la de ebullición se igualan. A la presión de 611.73 Pa (6.11 mbar) y la temperatura de 273.16 K se produce el equilibrio térmico entre las tres fases. A este punto se lo conoce como punto triple del agua.
3 Propiedades del agua
Si tenemos una cantidad de agua (líquida) a una cierta temperatura y la presión a la que se encuentra es superior a la que produciría ebullición a esa temperatura, se dice que es un líquido comprimido (ya que la presión exterior la mantiene en estado líquido) o líquido subenfriado (ya que se encuentra por debajo de su temperatura de ebullición).
Esta es la situación habitual entre 0°C y 100°C a la presión de una atmósfera. A esta presión, el agua tiene una densidad que es aproximadamente igual a 1000 kg/m³. Esta densidad, no obstante, depende ligeramente de la temperatura
T(°C) ρ (kg/m³) T(°C) ρ (kg/m³) T(°C) ρ (kg/m³)
0.01 999.8 35 994.1 70 978
5 1000 40 992.3 75 975
10 999.7026 45 990.2 80 972
15 999.1026 50 988 85 968
20 998.2071 55 986 90 965
25 997.0479 60 983 95 962
30 995.6502 65 980 100 958
De esta tabla y esta gráfica, salta a la vista otra propiedad del agua que la hace diferente al resto de sustancias: la densidad no disminuye monótonamente, sino que tiene un máximo. Esto quiere decir que, en general el agua caliente es más ligera que el agua fría y por tanto, tenderá a ir hacia la superficie, pero a temperaturas próximas a 0°C la tendencia se invierte y el agua más caliente es más pesada que la fría. El máximo de densidad se alcanza a 4ºC. Esto es lo que se conoce como anomalía térmica del agua.
Esta propiedad permite que el agua de un lago no se congele por completo. Si no hubiera anomalía, el agua más caliente quedaría en la superficie, donde se iría enfriando, cayendo al fondo y siendo sustituida por agua caliente, que se enfriaría a su vez, etc, hasta que todo quedara congelado. Al existir la anomalía esto no se produce porque el agua más caliente se queda abajo y el calor solo se pierde por conducción y no por convección, lo que es mucho más lento.
jueves, 5 de mayo de 2016
miércoles, 4 de mayo de 2016
lunes, 2 de mayo de 2016
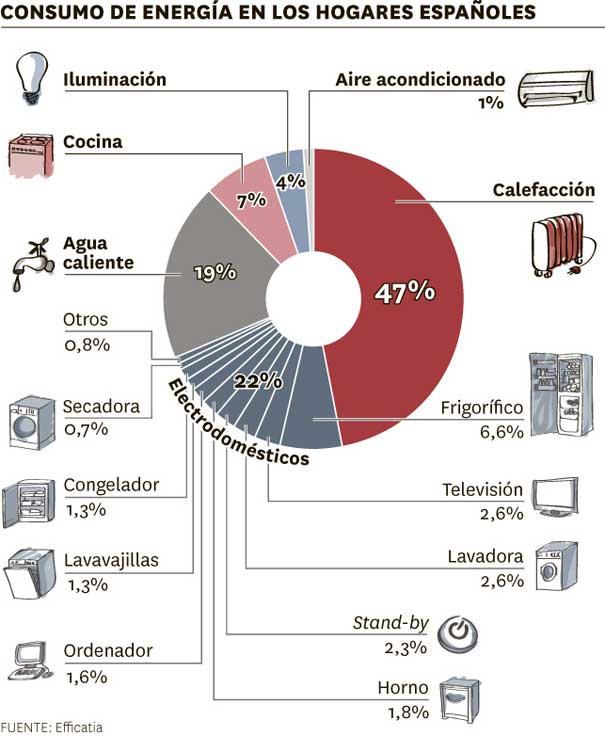
MEDIDAS PARA AHORRAR ELECTRICIDAD
Consejos para el ahorro de energia en el hogar
Cada uno de los aparatos eléctricos que se usan en el hogar, consumen diferentes cantidades de energía, dependiendo de su eficiencia energética y de cuánto tiempo los utilice usted al día o a la semana, así como de otras condiciones.
Iluminación

Sustituya sus lámparas incandescentes (focos) por lámparas fluorescentes compactas (ahorradoras)
La iluminación representa una tercera parte del consumo de energía en los hogares y, por ende, de lo que se paga en el recibo por consumo de electricidad.
El sustituir las lámparas ineficientes por eficientes da como resultado un ahorro de energía de 50% a 75% y, además, producen igual o mayor iluminación.
Los beneficios de las lámparas fluorescentes compactas contra las lámparas incandescentes son:
• Duran hasta 10 veces más
• Aportan mayor Iluminación
• Consumen una tercera parte de energía
• Aportan menos calor
Actualmente existe una gran variedad de modelos de lámparas fluorescentes compactas para sustituir directamente a una lámpara incandescente.
| Incandescente (Lámpara ineficiente) | Fluorescente Compacta (Lámpara eficiente) |
| 100 W | 26 W |
| 75 W | 20 W |
| 60 W | 13 W |
| 40 W | 11 W |
Recomendaciones:Compre sólo lámparas fluorescentes compactas de marca reconocida. Y para mantener la misma tonalidad de luz, adquiera las lámparas que tienen en el empaque leyendas como “luz cálida” o “luz amarilla”.
Aproveche al máximo la luz natural
Apague la iluminación en las áreas donde se tenga suficiente aportación de luz natural, así como en las áreas exteriores.
Realice una buena limpieza en las lámparas que se encuentren sucias, lo que mejorará el nivel deiluminación.
Si vive en un lugar de clima cálido, cierre las persianas en el día, pues al abrirlas entrará la luz natural, pero también el calor y, en todo caso, el costo de la iluminación artificial es más bajo que el de climatizar la habitación.
Pinte las paredes de su hogar con colores claros; esto ayuda a aprovechar mejor la luz, tanto la natural como la artificial.
Realice el mayor número de actividades aprovechando la luz solar. Piense o haga una lista de todo lo que puede realizar durante el día y no dejarlo para la noche. Por ejemplo, es mejor lavar, planchar y hacer el aseo durante el día con luz natural.
Aparatos electrodomésticos
Cada uno de los aparatos eléctricos que se usan en el hogar consumen diferentes cantidades deenergía, dependiendo de su eficiencia energética y de cuánto tiempo los utilice usted al día o a la semana, así como de otras condiciones.
Por ejemplo, el tostador de pan y la plancha funcionan con resistencias que convierten laelectricidad en calor y consumen mucha energía; sin embargo, el tostador se utiliza sólo durante algunos minutos, mientras que la plancha se usa más tiempo y, por lo mismo, consume más electricidad.
Los motores de la lavadora de ropa, de la aspiradora y la licuadora tienen diferentes potencias y, por ende, es diferente su nivel de consumo eléctrico. Lo mismo podemos decir del radio y de la televisión: si ambos están encendidos muchas horas, usted pagará más por lo que consuma el televisor que por el radio, ya que el primero es de una mayor potencia.
Cabe señalar que la iluminación representa la tercera parte del consumo de energía eléctrica en elhogar, pero si usted tiene un sistema de aire acondicionado en su casa, el panorama puede ser otro. El refrigerador es también uno de los aparatos que más consumen energía y debido a ello, en este mismo portal le hemos dedicado una sección especial.
En usos normales, los aparatos que más consumen energía se enlistan a continuación en un orden decreciente, el cual puede variar en función de los watts de potencia de cada uno y del tiempo que usted los utilice al día, semana o mes:
- Refrigerador
- Lavadora y plancha
- Computadora y televisión
- Audio y video
- Mas aparatos electrodomésticos
Todos estos aparatos son de una gran utilidad para los miembros de la familia y, particularmente, para el ama de casa; por lo mismo, conviene observar las siguientes recomendaciones:
- Mantenga siempre limpios los aparatos eléctricos, principalmente los de la cocina. Elimine los residuos de alimentos en el horno de microondas, tostador, extractor, etc. Conservarlos en buen estado prolonga su duración y reduce el consumo de energía y los gastos, como también contribuye a la seguridad de la familia
- Utilice todos los aparatos de acuerdo con las recomendaciones de uso, mantenimiento y seguridad que aconseje el fabricante
- Revise cuidadosamente aquellos aparatos que al conectarse producen chispas o calientan el cable. No los use antes de resolver el problema. En todo caso, es recomendable que esto lo haga un técnico calificado
- Apague los aparatos que producen calor antes de terminar de usarlos -plancha. tubos o pinzas para el cabello, parrillas, ollas eléctricas, calefactores- para aprovechar el calor acumulado
- Desconecte los aparatos desde la clavija, nunca jale el cable. Es importante mantener en buen estado tanto el cable como el enchufe
- Evite mantener encendidos innecesariamente televisores, videocasseteras, equipos de sonido y todos aquellos aparatos que no se estén utilizando, ya que además de desperdiciar energía, los equipos tendrán un envejecimiento más rápido y acabarán por no servir
- Pique la comida antes de licuarla, afile las aspas de la licuadora periódicamente y cámbielas si se rompen
Recomendaciones Refrigerador
Tome en cuenta las siguientes recomendaciones:
- Coloque el refrigerador en un lugar con suficiente espacio para permitir la circulación del aire por la parte posterior (10 cm aproximadamente) y evite colocar objetos que obstruyan una adecuada ventilación, ya que de lo contrario el aparato trabajará más y, por tanto, tendrá un mayor consumo de electricidad.
- Instálelo en donde no esté al alcance de los rayos solares, la estufa, el calentador de agua y otras fuentes de calor, pues cerca de ellos tiene que trabajar más.
- Revise que el refrigerador esté nivelado, ya que si su base o el piso están desnivelados, el empaque de la puerta sellará mal.
- Asegúrese que la puerta cierre herméticamente y que no deje que el aire frío se escape. Esto lo puede comprobar poniendo una hoja de papel al cerrar la puerta; si ésta cae o se desliza.
- Verifique que la puerta esté bien cerrada y no la deje entreabierta, pues un refrigerador trabaja con mayor eficiencia cuando se abre lo menos posible.
- Evite introducir alimentos calientes dentro del aparato, permita que se enfríen a la intemperie antes de guardarlos, pues de este modo trabajará menos su refrigerador.
- Use la temperatura correcta para conservar los alimentos. El ajuste del termostato debe estar entre los números 2 y 3 en lugares de clima templado y entre 3 y 4 en sitios calurosos.
- Mantenga los alimentos cubiertos, así se conservan mejor y será menor el acumulamiento de humedad en el interior del refrigerador.
- Descongele con regularidad su congelador, si es de deshielo manual. En refrigeradores de este tipo o semi-automáticos, revise que la cantidad de escarcha que se forma en el congelador no sobrepase el medio centímetro; descongélelo antes de que esto ocurra.
- Limpie periódicamente la parte posterior del refrigerador. Si la rejilla posterior está sucia, puede ocasionar costos más altos de operación del aparato. Las rejillas que se encuentran en la parte posterior o inferior delantera del mismo, deberán ser revisadas y limpiadas cuando menos dos veces por año.
- Si sale de vacaciones por más de 15 días, desconecte el refrigerador, límpielo y deje las puertas abiertas para que se ventile y no guarde olores desagradables.
Lavadora y plancha
Lavadora
Es un aparato importante en el hogar, ya que en gran parte depende de ella nuestra higiene personal.
Su consumo de electricidad es alto, pero usted puede reducirlo siguiendo los siguientes consejos:
- Deposite siempre la cantidad de ropa indicada como máximo permisible, ya que si pone menos, gastará agua y electricidad de más, y si pone más de lo permitido, la ropa quedará mal lavada y se corre el riesgo de forzar el motor.
- Use siempre el ciclo más corto posible para un lavado apropiado.
- Evite utilizar agua caliente en la lavadora, a menos que la ropa esté demasiado sucia. Además, asegúrese que el enjuague se haga con agua fría.
- En el caso de la secadora de ropa, utilícela sólo cuando sea indispensable; aproveche el sol para secar la ropa y eliminar bacterias.
Use sólo el detergente indispensable, el exceso produce mucha espuma y hace que el motor trabaje más de lo necesario.

Plancha
La plancha es uno de los aparatos que más consume energía, por eso es conveniente seguir las siguientes recomendaciones:
- Manténgala en buen estado general.
- Revise que las mangueras de succión estén en buenas condiciones.
- Procure utilizar la boquilla adecuada a la superficie que va a aspirar.
- Limpie los filtros al terminar de usarla.
Televisión
Es frecuente que en los hogares no sólo haya un televisor, sino dos o más, cuyo consumo de energía eléctrica va a depender, sobre todo, del tiempo que éstos permanezcan encendidos. Por ello, le sugerimos aplicar las siguientes recomendaciones de ahorro:
- Encienda el televisor sólo cuando realmente desee ver algún programa. (Recuerde que para oír música solamente, es mejor usar un radio, ya que éste consume menos energía).
- Reúna a los miembros de la familia ante un mismo aparato televisor cuando deseen ver el mismo programa.
- Mantenga bajos los niveles de iluminación en el lugar donde está instalado el televisor, así se evitarán los reflejos en la pantalla y ahorrará energía en iluminación.
- Use el reloj programador (sleep-timer); de esta manera, el aparato se apagará en caso de que a usted lo venza el sueño antes de terminar de ver su programa.
- Si su televisor utiliza regulador de voltaje, apáguelo también cuando deje de ver la televisión.
Audio y video
Cada uno de los aparatos eléctricos que se usan en el hogar, consumen diferentes cantidades de energía, dependiendo de su eficiencia energética y de cuánto tiempo los utilice usted al día o a la semana, así como de otras condiciones.
Por ejemplo, si el radio y la televisión están encendidos muchas horas, usted pagará más por lo que consuma el televisor que por el radio, ya que el primero es de una mayor potencia.
Estos aparatos son de una gran utilidad para los miembros de la familia, y particularmente para el ama de casa, por lo que conviene observar las siguientes recomendaciones:
- No deje encendidos radios, televisores u otros aparatos eléctricos cuando nadie los está utilizando.
- Mantenga siempre limpios los aparatos eléctricos. Conservarlos en buen estado prolonga su duración y reduce el consumo de energía y los gastos, como también contribuye a la seguridad de la familia.
- Utilice todos los aparatos de acuerdo con las recomendaciones de uso, mantenimiento y seguridad que aconseje el fabricante.
- Revise cuidadosamente aquellos aparatos que al conectarse producen chispas o calientan el cable. No los use antes de resolver el problema. En todo caso, es recomendable que esto lo haga un técnico calificado.
- Desconecte los aparatos desde la clavija, nunca jale el cable. Es importante mantener en buen estado tanto el cable como el enchufe.
- Evite mantener encendidos innecesariamente televisores, videocaseteras, dvd’s, equipos de sonido y todos aquellos aparatos que no se estén utilizando, ya que además de desperdiciar energía, los equipos tendrán un envejecimiento más rápido y acabarán por no servir.
Energía en espera “vampiros”
En los últimos años, el desarrollo de la electrónica se ha intensificado en diversos campos, incluyendo a los aparatos electrodomésticos y de oficina. Si bien con ello se ha incrementado la confiabilidad, funcionalidad y eficiencia de los mismos, el avance tecnológico ha implicado que muchos de estos equipos al permanecer conectados (como "vampiros") al circuito de alimentación eléctrica, continúen consumiendo energía aun cuando permanezcan supuestamente "apagados" o no estén efectuando su principal función, lo que significa un desperdicio de electricidad que el usuario tiene que pagar.
A este consumo de energía que realizan diversos aparatos electrónicos de manera pasiva, se le conoce como: energía de espera, energía de reposo, modo inactivo o modo dormido, aunque también se le considera como energía de desperdicio ("standby power", "sleep mode", "standby losses" o "leaking electricity", respectivamente, por sus denominaciones en inglés), su crecimiento ha sido tan rápido como su aplicación en cada vez más electrodomésticos.
Se ha podido confirmar que algunos de los equipos que permanecen conectados las 24 horas del día llegan a consumir más energía -o desperdiciarla- que cuando están en uso efectivo; por ejemplo, un mini componente de audio de cierta marca consume 30 watts "apagado" y 36 encendido; además, hay que tomar en cuenta que en cualquier hogar puede haber hasta 10 ó más "vampiros", que realizan un consumo continuo, acumulativo y sin utilidad; en casos críticos, esto equivale a tener encendido un foco de 60 watts todos los días.
¿Qué hacer para evitar estos consumos?
Para reducir los consumos parásitos o innecesarios de estos equipos, se debe entender que la energía está siempre en función de la potencia y el tiempo; por ello, nos conviene reducir el tiempo de uso o consumo de energía, lo que puede ser tan simple o sofisticado como lo siguiente:
- Desconecte la carga (retirar la clavija del contacto).
- Use un interruptor manual o un multicontactos desde el cual se pueda cortar la corriente de suministro.
Utilice elementos más sofisticados, como en las computadoras, para apagar totalmente el equipo, pero sin desconfigurar sus funciones. www.ecoportal.net
Enviado por Medio-ambiente
jueves, 7 de abril de 2016
ACCIDENTE DE CHERNOBYL
PRESENTACIÓN EN POWERPOINT "RESEÑA CHERNOBYL
https://drive.google.com/file/d/0BzqKDoq2f095SU9pSWs4RFBheGc/view?usp=sharing
https://drive.google.com/file/d/0BzqKDoq2f095SU9pSWs4RFBheGc/view?usp=sharing
CARACTERÍSTICAS DEL MODELO CINÉTICO DE PARTÍCULAS
Modelo cinético de partículas


Toda la materia está formada por partículas.
Las partículas se encuentran siempre en movimiento.
Las partículas interaccionan entre sí con fuerzas de mayor o menor intensidad
La distancia que existe entre partícula y partícula es muy grande en comparación con su tamaño
Los choques entre partícula-partícula y entre la partícula y la pared del recipiente en donde se encuentran ocurren sin pérdida de energía.
La energía cinética promedio de las partículas es proporcional a su temperatura.

Las partículas se encuentran siempre en movimiento.
Las partículas interaccionan entre sí con fuerzas de mayor o menor intensidad
La distancia que existe entre partícula y partícula es muy grande en comparación con su tamaño
Los choques entre partícula-partícula y entre la partícula y la pared del recipiente en donde se encuentran ocurren sin pérdida de energía.
La energía cinética promedio de las partículas es proporcional a su temperatura.

Paráfrasis: El perfume es liquido, pero al momento de aplicarlo, sale
cortándose partículas tan pequeñas que no son visibles para el ojo humano, es
decir, son microscopias.Estas partículas se quedan en el aire y se mueven todo
el tiempo. Por ello podemos olerlas mas no verlas. Ahora el perfume pasa a
formar de un gas enorme: el aire. El aire esta compuesto por millones de
partículas que chocan con las partículas del perfume haciendo que se muevan.
Entre partículas existe un espacio llamado vacío.
Teoría cinética de
los gases:
Fue propuesta por Maxwell Boltzmann, fue resultado del estudio del comportamiento de los gases. Para elaborar un modelo exitoso es necesario contemplar las características o variables que sean mas relevantes para la descripción y explicación del sistema, proceso u objeto a modelar. En este caso, las consideraciones que tuvieron Maxwell y Boltzmann para la creación de su modelo fueron:
Fue propuesta por Maxwell Boltzmann, fue resultado del estudio del comportamiento de los gases. Para elaborar un modelo exitoso es necesario contemplar las características o variables que sean mas relevantes para la descripción y explicación del sistema, proceso u objeto a modelar. En este caso, las consideraciones que tuvieron Maxwell y Boltzmann para la creación de su modelo fueron:
·
Los gases están formados por partículas que se mueven al azar.
·
Las partículas son esféricas, microscópicas e indivisibles.
· Las partículas tienen masa, están en constante movimiento y solo interactúan unas con otras cuando chocan entre si.
· Las partículas tienen masa, están en constante movimiento y solo interactúan unas con otras cuando chocan entre si.
·
La energía cinética promedio que tengan
las partículas determinará la temperatura del gas. A mayor cinética promedio,
mayor temperatura del gas.
·
La velocidad de movimiento de las partículas determinará su energía
cinética. A mayor velocidad, mayor energía cinética.
· Las partículas están separadas entre si por distancias muy grandes,
comparadas con el tamaño de las mismas.
·
Entre una partícula y otra hay vacío.
·
El numero de partículas que forman un gas es muy grande, de manera que
es posible utilizar estadística para su
análisis.
·
Cuando las partículas chocan entre si o contra las paredes del
recipiente que contiene el gas, no hay pérdidas de energía
mecánica (energía cinética y potencial)
·
El movimiento de cada partícula obedece las leyes del movimiento de
Newton.
Postulados que
complementan la teoría cinética de los gases:
a) La materia es
discontinua, es decir, esta formada por un gran número
de partículas separadas entre si.
b)
Dichas partículas se encuentran en constante movimiento debido a dos
clases de fuerzas; de cohesión y de repulsión.
Cohesión: Las fuerzas de cohesión tienden a mantener
las partículas unidas entre si.
Repulsión: Las fuerzas de repulsión tienden a
dispersar las partículas y alejarlas unas de otras.
desarrollo
Histórico del Modelo Cinético de Partícula
El modelo cinético
de partícula es la teoría que actualmente se acepta como cierta y que explica
que toda la materia esta formada por partículas (átomos),
que están vibrando y dependiendo como vibren o se muevan el material
será sólido, líquido o gas. Pero esto no siempre se supo; a continuación se
explica como a lo largo de los años el humano llego a construir el Modelo Cinético de Partícula.
Modelo cinético de John Dalton
Modelo cinético de Isaac Newton

Modelo cinético de
Daniel Bernoulli




En resumen: El Modelo Cinético
de Partícula
·
Los gases están formados por partículas (átomos y
moléculas)
·
Las partículas se mueven en
todas direcciones
·
Las partículas se mueven a
velocidades diferentes.
·
Las partículas son extremadamente
pequeñas pero al estar en movimiento constante ocupan mucho espacio, mucho volumen.
·
Entre las partículas de un gas no
existen fuerzas de atracción ni repulsivas.
·
Al recibir calor las partículas se mueven mas; y al enfriarse se mueven menos.
·
Al presionar un gas las partículas se mueven mas.
La
historia de la teoría cinética de los gases
La teoría cinética de los gases, propuesta en el siglo XIX por Maxwell Y
Boltzmann, fue el resultado del estudio del comportamiento de los gases. Para
elaborar un modelo exitoso es necesario contemplar las características o
variables que sean más relevantes para la descripción y explicación del
sistema, proceso u objeto a modelar.
10 consideraciones de Maxwell
1.
Los gases están formados por partículas que se mueven al azar.
2.
Las partículas son esféricas, microscópicas e indivisibles.
3.
Las partículas tienen masa, están en constante movimiento y solo
interactúan unas con otras
cuando
chocan entre sí.
4.
La energía cinética promedio que tengan las partículas determinará la
temperatura del gas. A
mayor
energía cinética promedio, mayor temperatura del gas.
5.
La velocidad de movimiento de las partículas determinará su energía
cinética. A mayor
velocidad,
mayor energía cinética.
6.
Las partículas están separadas entre sí por distancias muy grandes,
comparadas con el tamaño
de
las mismas.
7.
Entre las partículas y otra, hay vacío.
8.
El número de partículas que forman un gas es muy grande, de manera que
es posible utilizar
estadística
para su análisis.
9.
Cuando las partículas chocan entre sí o contra las paredes del recipiente
que contiene el gas,
no
hay pérdidas de energía mecánica (energía cinética y potencia).
10.
El movimiento de cada partícula obedece las leyes del movimiento de
Newton.



Postulados de la teoría cinética de los gases
"Los gases están constituidos por partículas que se mueven en línea
recta y al azar"
"El volumen de las partículas se considera despreciable comparado
con el volumen del gas"
Cohesión: Las fuerzas de cohesión son las fuerzas que atraen y
mantienen unidas las moléculas. Es la acción o la propiedad de las moléculas,
de como se pegan entre sí, siendo fuerzas de carácter atractivo.
Repulsión: La fuerza de repulsión es
aquella que ocasiona que dos cuerpos al intentar acercarlos, los obliga a
alejarse.
El perfume pasa a formar un gas enorme. el aire que este esta compuesto
de millones de partículas que chocan con las partículas del perfume.Entre las
partículas existe un espacio llamado vacío.
1.
Los gases están conformados por partículas que se mueven al azar
2.
Las partículas son esféricas, microscópicas e indivisibles
3.
las partículas tienen masa están en constante movimiento y solo
interactúan unas con otras cunado chocan entre si.
4.
La energía cinética promedio que tengan las
partículas determinará la temperatura del gas. A mayor energía promedio, mayor
temperatura del gas.
5.
La velocidad del movimiento de partículas determinará su energía
cinética. A mayor velocidad mayor energía cinética.
6.
Las partículas están separadas entre sí por distancias muy grandes
comparas con el tamaño de las mismas.
7.
Entre una partícula y otra hay vacío
8.
El número de partículas que forman un gas es muy grande la manera que es
posible utilizar estadística para su análisis.
9.
Cuando las partículas chocan entre sí o contra las paredes o contra
el recipiente que tiene el gas, no hay pérdidas de energía mecánica.( energía
cinética y potencia)
10.
El movimiento de cada partícula obedece las leyes del movimiento de
Newton.
DOS POSTULADOS
FUNDAMENTALES:
1.
La materia es discontinua, es decir, esta compuesta por un gran número
de partículas separadas entre si.
2.
Dichas partículas se encuentran en constante movimiento divido a dos
clases de fuerzas: cohesión y repulsión
COHESIÓN:
Adhesión de las cosas entre sí o entre las materias de que están formadas:
si mostramos cohesión no podrán con nosotros.
Unión de dos cosas.
unión recíproca entre las moléculas de una sustancia homogénea.
Fuerza de atracción que mantiene las moléculas unidas.
si mostramos cohesión no podrán con nosotros.
Unión de dos cosas.
unión recíproca entre las moléculas de una sustancia homogénea.
Fuerza de atracción que mantiene las moléculas unidas.
REPULSIÓN:
Sentimiento de repugnancia hacia algo.
Rechazo u oposición.
Fuerza que tiende a separar un cuerpo de otro o a no admitirlo en su propia masa o composición.
ESTADOS DE AGREGACIÓN
DE LA MATERIA
NOMBRES QUE SE LES
ASIGNA A LOS CAMBIOS DE FASE DE UN ESTADO DE AGREGACIÓN A OTRO:


Suscribirse a:
Comentarios (Atom)
